Korrosionsvorgänge stellen Phasengrenzflächenreaktionen zwischen Metalloberflächen und festen, flüssigen und gasförmigen Korrosionsmedien dar. Die Korrosionsreaktion ist in der überwiegenden Zahl aller Korrosionsfälle elektrochemischer Art.
Eine elektrochemische Korrosion erfolgt unter drei Voraussetzungen:
- Es müssen zwei verschieden edle (verschieden korrosionsbeständige) Metalle oder Metalloberflächen vorliegen. Hieraus ergibt sich eine Spannungs- oder Potentialdifferenz, die die treibende Kraft für das Fließen eines Korrosionsstroms ist.
- Zwischen den beiden Elektroden muss eine elektrisch leitende Verbindung bestehen.
- Beide Elektroden müssen von demselben Elektrolyten bedeckt sein, damit eine Ionenleitung stattfinden kann.
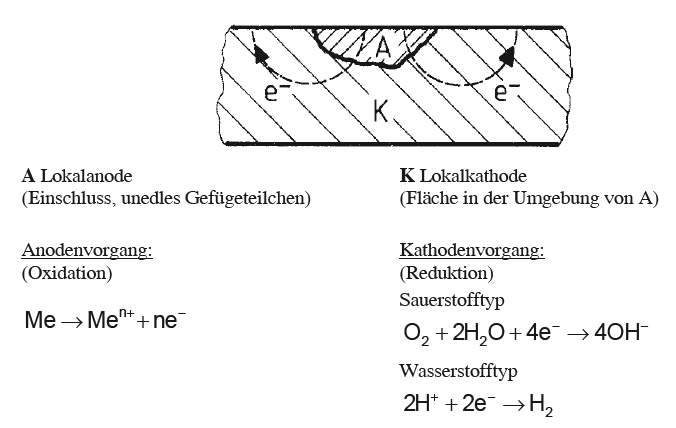
Wird die Korrosion an einem lokalen Element betrachtet, ergeben sich die folgenden Gegebenheiten und Prozesse. Die unedle Metalloberfläche bildet die Lokalanode (A) und die edlere Metalloberfläche der Umgebung die Lokalkathode (K). Während an der Lokalanode ein Oxidationsvorgang Metallionen freisetzt, wandern die im Metall verbleibenden Elektronen zur Lokalkathode und führen dort zu einem Reduktionsvorgang.
Im Bereich der anodischen Teilreaktion entsteht eine Metallauflösung.
Die Ordnung der Standardpotentiale von verschiedenen Metallen führt zur Normalspannungsreihe. Elektrochemisch werden Metalle mit einem positiven Potential als „edel“ und mit einem negativen Potential als „unedel“ bezeichnet. Ein Metall wird umso stärker korrodiert, je negativer sein Potential ist.

Für die Praxis gilt, dass das Verhältnis der Oberfläche des Metalls mit anodischem (negativem) Potenzial gegenüber dem Metall mit kathodischem (positivem) Potenzial hoch sein sollte, weil das Metall mit dem negativen Potenzial korrodiert wird. Wenn keine leitfähige Flüssigkeit (Wasser, Feuchtigkeit, Elektrolytfilm) vorhanden ist, kann der galvanische Stromkreis nicht geschlossen werden, der die Korrosion bedingt.
Literatur:
[1] Karl-Heinz Kloos & Wolfgang Thomala: „Schraubenverbindungen – Grundlagen, Berechnung, Eigenschaften, Handhabung“, Springer Verlag, Berlin Heidelberg New York 2007


Hinterlasse einen Kommentar